逆主流理论爆冷摘得2025诺贝尔生医奖,免疫“刹车”机制终获认可
当地时间10月6日11时30分,2025年诺贝尔生理学或医学奖公布,授予玛丽·布伦科(Mary E. Brunkow), 弗雷德·拉姆斯德尔(Fred Ramsdell)和坂口志文(Shimon Sakaguchi),表彰“他们关于外周免疫耐受的发现”。
三位获奖者识别出了免疫系统的“安全卫士”——调节性T细胞(regulatory T cells),这些细胞防止免疫系统错误地攻击机体自身。“他们的发现对我们理解免疫系统的运作机制,以及为什么人类不会普遍患上严重的自身免疫性疾病,具有决定性意义。”诺贝尔委员会主席奥勒·坎佩(Olle Kämpe)表示。三位获奖者的发现开启了外周免疫耐受研究领域,并推动了用于癌症与自身免疫性疾病治疗的新型医学策略的开发。这些成果也为器官移植成功率的提高带来了新的希望。目前,多项基于这一机制的临床治疗方案已进入临床试验阶段。
河北体育学院运动人体科学系教授郭晓强接受《返朴》采访时表示,今年诺贝尔生医奖可以说是爆了一个“大冷”,首先大家原以为是“应用年”却颁发给了基础项目;其次,今年如果发给免疫学领域,是否B细胞、T细胞和T调节细胞三位科学家分享更为合适?因为这一发奖预示着前两种细胞发现基本上极大概率不会再获奖了。
此外,郭晓强还表示,坂口志文和拉姆斯德尔等(另一位是Alexander Rudensky)因该发现曾获得过瑞典的克拉福德奖(诺贝尔奖补充奖),原本大家都认为不会“梅开二度”,同一项发现被同一个委员会颁发两次奖,鉴于物理奖已有先例【如2005年克拉福德奖获得者皮布尔斯(James Peebles)分享2019年诺贝尔物理学奖,2012年克拉福德奖获得者根泽尔(Reinhard Genzel)和盖兹(Andrea Ghez)分享2020年诺贝尔物理学奖】,这里也就显得不奇怪了。
中国科协研究员/中国科大副教授李旭在接受《返朴》采访时表示:“感觉今年的诺贝尔生理学或医学奖是继去年给了微小RNA之后,再一次给我的冷门震撼。因为按照规律,大家都在猜“逢5逢10”的年头应该要给医学相关的成果,就是临床导向会比较强的工作,但这一次给了免疫。不过虽然让人吃惊,也在情理之中。它是作为很多现在正在高速发展的临床治疗方法的核心基础。无论癌症治疗过程中对于被诱降的那部分免疫细胞如何清除,还是在治疗自身免疫疾病的时候,如何增加体内调节T细胞的数量,都是依靠这一套实验结果予以理论支持的。这也算是为临床提供了强有力的支持。”

获奖者简介
他们揭示了免疫系统的调控机制

玛丽·布伦科(Mary E. Brunkow):1961 年出生,获美国普林斯顿大学(Princeton University)博士学位,现任美国西雅图系统生物学研究所高级项目主管(Senior Program Manager)。

弗雷德·拉姆斯德尔(Fred Ramsdell) :1960 年出生,1987 年获美国加利福尼亚大学洛杉矶分校(University of California, Los Angeles)博士学位,现任美国旧金山索诺玛生物治疗公司科学顾问(Scientific Advisor)。

坂口志文(Shimon Sakaguchi) :1951 年出生,1976 年获医学博士学位,1983 年获日本京都大学(Kyoto University)博士学位,现任日本大阪大学免疫学前沿研究中心(Immunology Frontier Research Center)杰出教授(Distinguished Professor)。
翻译 | 郭晓强、顾舒晨、汪润、常恺
人体强大的免疫系统必须受到精确调节,才能避免其对自身组织产生攻击。玛丽·E·布伦科(Mary E. Brunkow)、弗雷德·拉姆斯德尔(Fred Ramsdell)和坂口志文(Shimon Sakaguchi)因其关于外周免疫耐受(peripheral immune tolerance)的开创性发现而获得 2025 年诺贝尔生理学或医学奖。这些发现奠定了一个全新研究领域的基础,并推动了新疗法的发展,例如用于癌症和自身免疫病的治疗。
免疫系统是进化上的杰作。它每天保护我们免受成千上万种病毒、细菌和其他微生物的侵袭。没有免疫系统,我们无法生存。
免疫系统的奇迹之一是它能识别病原体,并将其与自身细胞区分开来。威胁我们健康的微生物并没有统一的外观——它们形态各异,有些甚至伪装得像人类细胞。那么,免疫系统是如何判断该攻击什么、保护什么的呢?为什么它不会频繁攻击我们自己的身体?
研究者曾长期认为答案在于中枢免疫耐受(central tolerance):即T细胞在成熟过程中会经历筛选,清除那些识别自身组织的细胞。但事实证明,免疫系统远比想象中复杂。布伦科、拉姆斯德尔和坂口志文因其关于外周免疫耐受的发现揭示了免疫系统的“安保”人员——调节性 T 细胞(regulatory T cell, Treg),从而开辟了一个新的研究领域。这些发现也推动了潜在医疗手段的发展,目前这些方法正在临床试验中评估,有望用由此治疗或治愈自身免疫病、提升癌症治疗效果,并预防造血干细胞移植后的严重并发症。

图1
1990 年代免疫学的初舞台:T 细胞
让我们先简要回到 1990 年代,了解研究者当时对 T 细胞的认识——这些至关重要的“守护者”正是我们故事的主角。T细胞包括:
辅助性 T 细胞(helper T cell),它不断巡逻全身。一旦发现入侵微生物,它们会警示其他免疫细胞共同发起攻击。
杀伤性 T 细胞(killer T cell),它负责清除被病毒或其他病原体感染的细胞,也能攻击肿瘤细胞。
除了这些还有其他具不同功能的免疫细胞。但在这段故事里,T 细胞是绝对主角。
发现入侵者的“传感器”
所有T细胞表面都有特殊的T细胞受体(T-cell receptors,TCR),它们可以被认为是身体的“传感器”,借助它们,T细胞能“扫描”其他细胞,判断身体是否遭到攻击。TCR的特殊之处在于:它们像拼图一样,每个受体的形状都不同,由许多基因随机组合而成。理论上,人体可以制造超过一千万亿种不同的TCR。

图2. T细胞如何发现病毒 | 诺贝尔生理学或医学奖委员会 插图:Mattias Karlén
这群数量庞大、形状各异的T细胞可以确保在被不同微生物入侵时,总有一些TCR能够进行准确识别(图2),包括像2019年引发新冠大流行的全新病毒SARS-CoV-2。但是,机体在制造如此多样的T细胞受体的同时,也不可避免地会产生能识别自身组织成分的T细胞受体。那么,T细胞为何会对外敌反应,却不攻击自身呢?
识别自身的T细胞会被淘汰
20世纪80年代的研究已表明:当T细胞在胸腺成熟时,会经历一种“筛选”,把识别自身蛋白的T细胞淘汰(见图 3)。这个筛选过程被称为中枢耐受(central tolerance)。
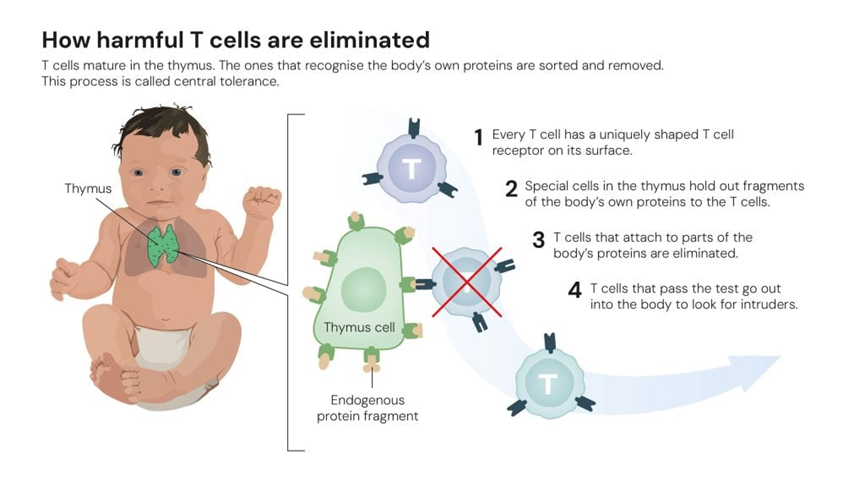
图3. 有害T细胞如何被清除 | 诺贝尔生理学或医学奖委员会 插图:Mattias Karlén
此外,一些研究者猜测还存在一种他们称为抑制性T细胞(suppressor T cell)的细胞类型,专门处理那些从胸腺筛选中“漏网”的自身反应性T细胞。但当时少数研究结论夸大,且部分证据被证明不可靠,整个假说因此被学界广泛否定,这一研究方向几乎被放弃。
坂口志文的直觉:免疫系统存在“保安”的角色
与主流相反,日本名古屋爱知癌症中心研究所(Aichi Cancer Center Research Institute in Nagoya, Japan)的坂口志文并未放弃。他受到一项早先被认为具有矛盾实验的启发:研究者切除新生小鼠的胸腺,以了解胸腺在T细胞发育中的作用。他们本以为小鼠会缺少T细胞、免疫反应减弱。但如果在出生后第3天进行切除,免疫系统却会失控,小鼠继而出现多种自身免疫疾病。
为进一步理解这一现象,20世纪80年代初,坂口志文从基因相同的小鼠中分离成熟的T细胞并回输给无胸腺小鼠。结果非常有趣:似乎存在一些T细胞能够保护这些小鼠免于自身免疫病(见图 4)。

图4. 激发坂口灵感的实验 | 诺贝尔生理学或医学奖委员会 插图:Mattias Karlén
这些结果让他确信:免疫系统一定存在某种“保安”的角色,能让其他T细胞冷静下来,保持克制不攻击自身。但它究竟是哪类细胞?
调节性 T 细胞的发现
区分T细胞时,研究者常依据其表面蛋白。辅助性 T 细胞可通过CD4蛋白识别,杀伤性T细胞则以CD8蛋白进行区分。
在保护小鼠免于自身免疫的实验中,坂口使用的是CD4⁺细胞——通常这些细胞会“唤醒”免疫系统并让其工作;然而在坂口的实验里,免疫反而被按下了刹车。他的结论是:CD4⁺ T 细胞并非同质群体,其中必定存在不同“子类”。
为了验证这一假设,坂口需要找到区分这些不同 T 细胞的方法。这花了他十多年时间。1995 年,他在《Journal of Immunology》上向世界介绍了一个全新的 T 细胞类别:这类能使免疫系统平静的细胞,不仅表达 CD4,还表达CD25(见图 5)。

图5. 坂口定义了一种新的T细胞类型|诺贝尔生理学或医学奖委员会 插图:Mattias Karlén
这种新发现的T细胞类型被命名为调节性T细胞。然而,许多研究者对它的存在仍持怀疑态度——他们希望看到更多确凿的证据,才能信服坂口志文的发现。关键的线索随后来自玛丽·E·布伦科和弗雷德·拉姆斯德尔。
接下来,2025年诺贝尔生理学或医学奖的故事进入了第二幕,而这一幕的序章,始于20世纪40年代美国一家实验室里,一群体弱多病的雄性小鼠的诞生。
一种突变导致免疫系统的叛乱
在一间位于美国田纳西州奥克里奇(Oak Ridge, Tennessee)的实验室中,研究人员正在研究辐射的后果。他们的工作隶属于曼哈顿计划(Manhattan Project),与原子弹的研制密切相关。
而今年诺贝尔奖故事中的关键小鼠品系,其实是一种进化上的偶然——一些雄性小鼠意外出生时皮肤呈现鳞屑和脱皮,脾脏和淋巴腺极度肿大,并且它们只能存活几周。
这个小鼠品系后来被命名为scurfy,并迅速吸引了研究人员的注意。当时分子遗传学还处在萌芽阶段,但他们意识到,造成这种疾病的突变必须位于小鼠的X染色体上。大约一半的雄性小鼠都患病,但雌性小鼠则可以带着突变生存,因为它们拥有两条X染色体,其中一条是健康的DNA。雌性小鼠因此将scurfy突变传递给了下一代。
到了1990年代——当分子工具变得更加精细时——研究人员开始调查为什么雄性scurfy小鼠会如此严重地患病。结果显示,它们的器官正遭到T细胞的攻击,组织被破坏。
出于某种原因,scurfy突变似乎引发了免疫系统内部的一场“叛变”。
布伦科和拉姆斯德尔寻找自身免疫疾病的解释
两位对scurfy突变产生兴趣的研究者是玛丽·E·布伦科和弗雷德·拉姆斯德尔。他们当时在位于美国华盛顿州Bothell的生物技术公司Celltech Chiroscience工作。该公司致力于开发治疗自身免疫疾病的药物,而Brunkow和Ramsdell意识到,scurfy小鼠可能在他们的研究中提供重要线索。如果他们能理解导致这些小鼠发病的分子机制,他们就能获得决定性的洞察,了解自身免疫疾病是如何产生的。因此,他们做出了一个关键的决定:他们要寻找scurfy小鼠的突变基因。
在今天,科学家可以在几天内绘制出小鼠的完整基因组并找到一个突变基因。但在1990年代,这就如同在巨大的干草堆中寻找一根针。小鼠X染色体上的DNA链大约由1.7亿个碱基对组成。
鼠的 X 染色体由大约 1.7 亿个碱基对组成。要在这庞大的 DNA 序列中找到一个微小的突变,虽然在理论上可行,却需要大量的时间、极大的耐心,以及对当时分子生物学工具的创造性运用。
布伦科和拉姆斯德尔在DNA干草堆中找到了“针”
基因定位结果表明,scurfy突变必须位于X染色体的中部。布伦科和拉姆斯德尔成功地将潜在区域缩小到了大约50万个碱基对。接着,他们开始了一项庞大的工作——对该区域进行详细的测序。
这个过程耗时极长,当布伦科和拉姆斯德尔完成后,他们确认该区域包含20个潜在基因。他们面临的下一个挑战是:将这些基因在健康小鼠和scurfy小鼠之间进行比较。
他们一个接一个地检查基因。直到第20个、也是最后一个基因时,他们终于可以喊出“Bingo!”。经过多年的专注努力,他们终于找到了scurfy突变(见图6)。

图6 布伦科和拉姆斯德尔发现了scurfy突变 | 诺贝尔生理学或医学委员会 插图:Mattias Karlén
此前未知的缺陷基因与叉头框基因(FOX)家族高度相似。这类基因通过调控其他基因活性影响细胞发育,布伦科和拉姆斯德尔将其命名为Foxp3。
IPEX疾病的致病机制
研究中,布伦科与拉姆斯德尔怀疑一种罕见自身免疫病——IPEX综合征(与X染色体相关)可能是人类版本的“scurfy小鼠”疾病。通过基因数据库比对,他们确定了人类FOXP3基因的存在。借助全球儿科医生的样本收集,团队证实IPEX患儿均携带该基因的有害突变。
2001年,两人在《自然·遗传学》发表关键结论:FOXP3基因突变同时导致IPEX综合征与小鼠疾病。这一发现引发全球实验室研究热潮。当学界将线索串联后,终于意识到FOXP3基因与坂口志文发现的调节性T细胞功能密切相关。
调节性T细胞——机体的免疫哨兵
两年后,坂口志文及后续研究团队确证了FOXP3基因对调节性T细胞发育的关键调控作用。这类细胞能阻止其他T细胞错误攻击自身组织(图7),这一机制被称为外周免疫耐受。此外,调节性T细胞还能确保免疫系统在清除病原体后及时“刹车”,避免持续过度激活。

图7. 调节性T细胞如何保护我们 | 诺贝尔生理学或医学奖委员会 插图:Mattias Karlén
医学应用突破
(1)肿瘤免疫治疗:肿瘤微环境会招募大量调节性T细胞形成保护屏障,阻碍免疫系统攻击。当前研究聚焦于“拆解”这层屏障,使免疫细胞得以识别并杀伤肿瘤。
(2)自身免疫病干预:通过补充白介素-2(IL-2)促进调节性T细胞增殖,已在临床试验中显示潜力。移植领域尝试利用IL-2抑制排斥反应,保护移植器官。
(3)细胞工程疗法:从患者体内提取调节性T细胞、体外扩增后回输,增强免疫调控能力。通过表面抗体标记,定向引导调节性T细胞至移植器官(如肝脏、肾脏),精准抑制免疫攻击。
科学意义
玛丽·布伦科、弗雷德·拉姆斯德尔与坂口志文的发现,揭示了免疫系统的“自控机制”,为癌症、自身免疫病及移植医学开辟了全新治疗范式
